Ces dernières années, la recherche a suggéré que le N-oxyde de triméthylamine (TMAO) pourrait être une cible thérapeutique pour la résistance à l’insuline et les cancers gastro-intestinaux (GI). Comme indiqué dans une revue scientifique de 2017 :1
« Grâce à la digestion des protéines animales et d’autres constituants des produits d’origine animale, les bactéries commensales de l’intestin (le microbiote intestinal) forment des métabolites qui peuvent contribuer au développement de la résistance à l’insuline et du cancer.
La triméthylamine-N-oxyde (TMAO) est une telle molécule et a récemment attiré beaucoup d’attention car elle peut être un facteur de risque pour – et un lien entre – le microbiote intestinal et les maladies cardiovasculaires et rénales.
En outre, le TMAO devrait avoir une importance en tant que biomarqueur – ou même facteur de risque indépendant – d’autres conditions indésirables, y compris la résistance à l’insuline… Le TMAO provient d’un précurseur, la triméthylamine (TMA) qui est un métabolite de divers précurseurs ; principalement de la choline et de la carnitine provenant des aliments ingérés. »
Dans un papier2 dirigé par James DiNicolantonio, Pharm.D., qui est également le co-auteur de mon livre, « Superfuel: Ketogenic Keys to Unlock the Secrets of Good Fats, Bad Fats, and Great Health », nous montrons comment la vraie cause probable d’un TMAO élevé niveaux – qui est associée à un risque accru de maladies cardiovasculaires (MCV) – est la résistance hépatique à l’insuline.
De plus, l’article montre que l’huile de krill, l’astaxanthine, l’huile de poisson et la berbérine peuvent être parmi les meilleures stratégies supplémentaires pour ceux qui ont des niveaux élevés de TMAO après l’optimisation de l’alimentation, car cela reflète simplement la résistance à l’insuline dans le foie.
DiNicolantonio a un livre intitulé « La solution de longévité« , avec le Dr Jason Fung, qui se penche sur les avantages des oméga-3, y compris l’huile de poisson et de krill.

Qu’est-ce qui cause des niveaux élevés de TMAO ?
Comme indiqué précédemment, le TMAO est créé lorsque les bactéries gastro-intestinales métabolisent la choline et la carnitine alimentaires présentes dans les œufs, le foie, la viande et le poisson, pour n’en nommer que quelques-unes. Les bactéries transforment la choline et la carnitine en triméthylamine, qui est ensuite absorbée et oxydée en TMAO à l’aide de flavine monooxygénases dans votre foie, principalement FMO3.
Les monooxygénases de flavine sont une famille d’enzymes qui oxydent les xénosubstrats, permettant ainsi aux composés d’être excrétés. Étant donné que la choline et la carnitine augmentent le TMAO, qui est considéré comme un facteur de risque de maladies cardiovasculaires et de diabète de type 2, certains recommandent de limiter l’apport alimentaire et supplémentaire de ces nutriments. Cependant, DiNicolantonio et ses co-auteurs soulignent qu’il y a une faille importante dans cette théorie, déclarant :3
« [N]l’épidémiologie nutritionnelle ne parvient pas à incriminer la choline alimentaire comme facteur de risque CV ; la carnitine supplémentaire est connue pour être hautement protectrice chez les patients atteints de maladies vasculaires ; et le poisson, la source alimentaire la plus riche en TMAO préformé, est également protecteur.
Par conséquent, le TMAO, du moins aux concentrations modérées observées chez les personnes sans insuffisance rénale sévère, n’est pas un facteur de risque médiateur de maladie vasculaire, mais sert plutôt de marqueur pour les facteurs qui favorisent la maladie vasculaire et le diabète.
L’insuffisance rénale est l’un de ces facteurs, mais pas le seul. La possibilité que certaines bactéries gastro-intestinales capables de générer de la triméthylamine soient également nocives pour la santé vasculaire et métabolique reste non documentée. Les facteurs qui augmentent la FMO3 hépatique sont donc suspects.
En effet, une activité insulinique hépatique inférieure à la normale associée à une résistance hépatique à l’insuline stimule l’expression hépatique de FMO3. La résistance hépatique à l’insuline peut résulter du syndrome métabolique et de l’obésité viscérale, et peut refléter une activité sous-optimale de l’adiponectine ou du peptide-1 de type glucagon, qui peuvent tous jouer un rôle médiateur dans les maladies CV et le diabète.
Les régimes, les nutraceutiques et les médicaments qui combattent la résistance hépatique à l’insuline peuvent donc être utiles pour atténuer les risques pour la santé associés à un TMAO élevé.
TMAO élevé – Un facteur de risque de maladies cardiovasculaires et métaboliques ?
Comme indiqué dans l’article présenté, les preuves reliant une TMAO élevée à un risque de MCV sont mitigées. Plusieurs études4,5,6,sept ont conclu que des taux sanguins élevés de TMAO sont prédictifs d’événements cardiovasculaires indésirables majeurs chez les personnes atteintes d’une maladie cardiaque préexistante, tandis que d’autres n’ont pas trouvé de support pour ce lien.8,9
Pourtant, une méta-analysedix des 11 études publiées en 2018 ont révélé que des niveaux plus élevés de TMAO étaient associés à un risque accru de 23 % d’événements cardiovasculaires et à une augmentation de 55 % de la mortalité toutes causes confondues. Des études animales citées dans l’article de DiNicolantonio suggèrent également que des doses orales très élevées de TMAO ou de ses précurseurs, la phosphatidylcholine et la carnitine, peuvent avoir un effet pro-athérogène.
Des études épidémiologiques cas-témoins ont également établi un lien entre un TMAO élevé et un risque significativement accru de diabète de type 2 et de syndrome métabolique. « En effet, les corrélations entre le TMAO et le risque de diabète semblent être plus fortes que celles du risque cardiovasculaire », écrit DiNicolantonio.
Cela dit, il y a peu de preuves suggérant que l’apport alimentaire de TMAO ou de ses précurseurs favorise réellement les maladies cardiovasculaires, à condition que votre fonction rénale soit normale. Au contraire, la choline est cruciale non seulement pour votre cerveau, votre système nerveux et votre fonction cardiovasculaire, mais aussi pour la fonction hépatique saine et la détoxification.
En fait, il semble être essentiel pour la prévention de la stéatose hépatique et se trouve en grande quantité dans des aliments tels que le poisson, qui sont connus pour leur influence bénéfique sur les maladies cardiovasculaires, en partie grâce aux avantages des oméga-3 à longue chaîne. graisses. DiNicolantonio écrit :11
« En ce qui concerne la carnitine et le risque CV, une méta-analyse12 des essais cliniques prospectifs chez des patients ayant récemment subi un infarctus du myocarde ont conclu que la supplémentation en carnitine est nettement protectrice vis-à-vis de la mortalité totale, des arythmies ventriculaires et de l’angor d’apparition récente…
Essais cliniques13,14 ont également signalé des effets favorables de carnitine ou d’esters de carnitine supplémentaires sur l’angine de poitrine, la claudication intermittente et l’insuffisance cardiaque.
De plus, des études d’athérogenèse sur des rongeurs, dans lesquelles la carnitine a été administrée à des doses raisonnablement proportionnelles aux doses de supplémentation utilisées en clinique, ont montré que la carnitine est anti-athérogène, malgré sa propension à augmenter le TMAO…
Il est donc raisonnable de soupçonner qu’un TMAO modérément élevé, plutôt que d’être un médiateur du risque CV associé, est un marqueur de facteurs qui favorisent à la fois les événements CV et augmentent le TMAO plasmatique. »
Une mauvaise fonction hépatique augmente considérablement le TMAO
Selon DiNicolantonio, un facteur clé semble être la résistance à l’insuline dans le foie, qui élève considérablement le TMAO. Il écrit:15
« Le TMAO survient lorsque la choline et la carnitine alimentaires sont métabolisées par des bactéries gastro-intestinales pour produire de la triméthylamine, qui est ensuite absorbée et oxydée en TMAO par les flavines monooxygénases hépatiques (FMO), principalement FMO3… une activité de l’insuline hépatique inférieure à la normale, comme on le trouve chez les personnes atteintes d’hépatite [liver] résistance à l’insuline, stimule l’expression hépatique de FMO3 et donc les niveaux de TMAO. »
DiNicolantonio poursuit en proposant qu’une activité FMO3 élevée dans le foie puisse être le reflet d’une résistance à l’insuline dans l’organe, qui à son tour influence le risque pour la santé cardiovasculaire. Cela, estime-t-il, « peut rationaliser l’épidémiologie du TMAO ». Il explique:16
« La résistance à l’insuline hépatique et sa stéatose hépatique concomitante courante sont associées à un risque cardiovasculaire accru, ainsi qu’à un risque accru de diabète de type 2 – risques également associés à une TMAO élevée.
Il est donc simple de postuler que le TMAO peut servir de marqueur de l’insulino-résistance hépatique, et que cela explique au moins une partie du risque d’événements cardiovasculaires et de diabète liés au TMAO.
Comment inverser la résistance à l’insuline dans votre foie
Si un TMAO élevé est en effet le reflet d’une résistance à l’insuline hépatique qui augmente votre risque de MCV, que pouvez-vous faire pour le corriger et réduire votre risque ? Pour commencer, vous voudriez normaliser votre poids.
Deux stratégies les plus utiles à cet égard sont un régime cétogène cyclique et un jeûne intermittent. Pour de meilleurs résultats, ils doivent être effectués ensemble. Vous pouvez en savoir plus sur ces stratégies dans les articles en hyperlien fournis. Certains suppléments peuvent également être très bénéfiques dans le traitement de la résistance à l’insuline hépatique, notamment :17
• Berbérine, qui fonctionne un peu comme la metformine, un médicament couramment utilisé pour le traitement du diabète. Les deux fonctionnent, au moins en partie, en activant la protéine kinase activée par l’adénosine monophosphate (AMPK). Connu sous le nom de « commutateur principal métabolique », l’AMPK est une enzyme qui contrôle la façon dont l’énergie est produite dans votre corps et comment elle est utilisée par les cellules.
En activant cette enzyme, la berbérine et la metformine aident à réguler les activités biologiques qui normalisent les déséquilibres lipidiques, glycémiques et énergétiques. La berbérine, utilisée en médecine chinoise pour traiter le diabète, s’est également avérée efficace contre la résistance hépatique à l’insuline chez les rongeurs diabétiques.18,19
• Astaxanthine, un antioxydant caroténoïde puissant, est un agoniste de PPARalpha avec une activité similaire à celle du fénofibrate, un médicament hypocholestérolémiant. Les agonistes de PPARalpha stimulent indirectement l’AMPK dans votre foie et il a été démontré qu’ils atténuent la résistance hépatique à l’insuline chez les animaux nourris avec des régimes riches en graisses ou en fructose, et réduisent le risque d’événements cardiovasculaires chez les patients atteints du syndrome métabolique.
• L’huile de krill est une autre alternative, car il contient la forme estérifiée de l’astaxanthine, qui augmente sa biodisponibilité, ainsi que des acides gras oméga-3 à longue chaîne essentiels à une bonne santé, y compris la santé cardiaque. Comme indiqué dans l’article de DiNicolantonio :
« L’huile de krill, même comparée à l’huile de poisson, supprime la stéatose hépatique chez les rongeurs. Cela peut être dû à sa teneur en astaxanthine, qui ne se trouve pas dans l’huile de poisson.
De plus, l’huile de krill, mais pas l’huile de poisson, réduit la teneur en diacylglycérol et en céramide dans le foie. Il a également été noté que la fraction phospholipidique de l’huile de krill réduit la production hépatique de glucose, contrairement à l’huile de poisson.
Ainsi, l’huile de krill, étant une source de forme hautement biodisponible d’astaxanthine, semble avoir des avantages supplémentaires pour réduire la stéatose hépatique et la résistance hépatique à l’insuline par rapport à l’huile de poisson. »
Aperçu sommaire des constatations
En résumé, bien qu’il existe des preuves suggérant que des niveaux élevés de TMAO peuvent être un facteur de risque pour le diabète de type 2, l’athérosclérose et un risque accru d’événements cardiovasculaires, les études d’épidémiologie nutritionnelle n’ont pas été en mesure de démontrer un impact néfaste de la choline et de la carnitine alimentaires, de lequel TMAO est synthétisé.
Les études ne soutiennent pas non plus l’idée que les sources alimentaires de TMAO, telles que le poisson, ont un impact néfaste sur la santé cardiovasculaire. Bien au contraire. L’article de DiNicolantonio propose que le seul moment où une TMAO élevée peut en fait être un facteur de risque de MCV est lorsqu’elle s’accompagne d’une mauvaise fonction hépatique, et une TMAO élevée peut elle-même être un signe de mauvaise fonction hépatique.
La bonne nouvelle est que vous pouvez améliorer la fonction hépatique et réduire votre niveau de TMAO à l’aide de suppléments nutritionnels. la berbérine, l’astaxanthine et l’huile de krill étant trois des principales. DiNicolantonio écrit :
« En conclusion, il y a des raisons de soupçonner que le risque élevé d’événements vasculaires et de diabète de type 2 associé à un TMAO élevé, après correction des facteurs de risque reconnus, est largement médié par la résistance hépatique à l’insuline et les facteurs métaboliques qui l’induisent…
[I]Si cette analyse est précise, diverses mesures qui atténuent l’insulinorésistance hépatique – correction de l’obésité viscérale, activation de l’AMPK avec de la metformine ou de la berbérine, activation de PPARalpha avec du fénofibrate ou de l’astaxanthine, amplification de la production d’adiponectine avec de la pioglitazone ou des régimes à base de plantes, et stratégies cliniques qui stimulent la production ou la bioactivité du GLP-1 – on pourrait s’attendre à ce qu’ils diminuent le TMAO élevé tout en diminuant le risque d’événements vasculaires et de diabète associés à ce facteur de risque. La figure 1 résume ces relations…
Il est important de noter que cette analyse n’exclut pas la possibilité que le TMAO soit directement pathogène aux niveaux très élevés généralement observés dans les dysfonctionnements rénaux graves. En effet, des études de culture cellulaire suggèrent que le TMAO peut être pro-inflammatoire dans les concentrations plasmatiques atteintes lors d’une insuffisance rénale. Il est généralement judicieux de minimiser la consommation de composés azotés dans ce contexte. »
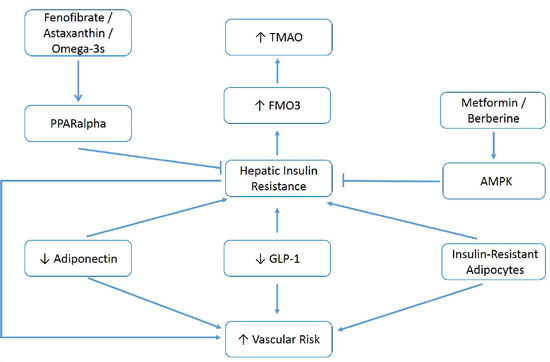
Figure 1 : Les mesures qui augmentent l’activité de l’adiponectine et du GLP-1, contrôlent le syndrome métabolique et activent l’AMPK hépatique ou le PPARalpha, peuvent diminuer le TMAO élevé et le risque vasculaire/métabolique associé.




Laisser un commentaire